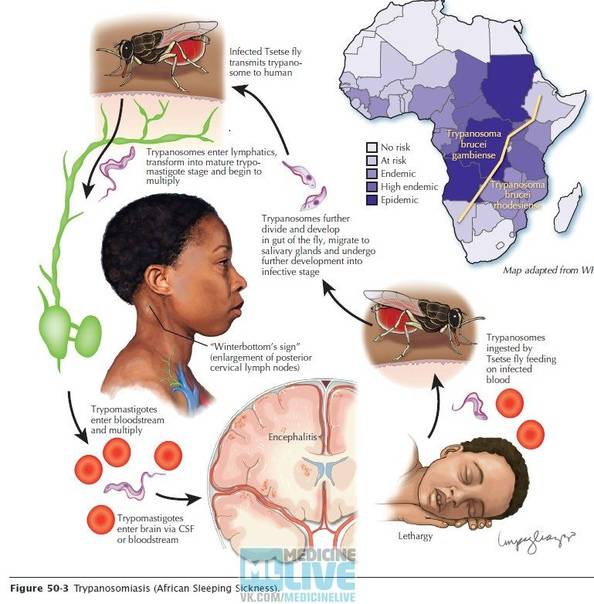
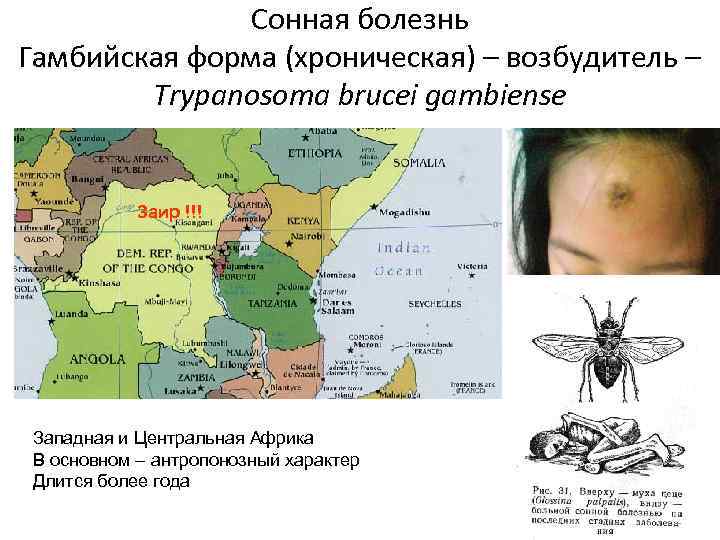
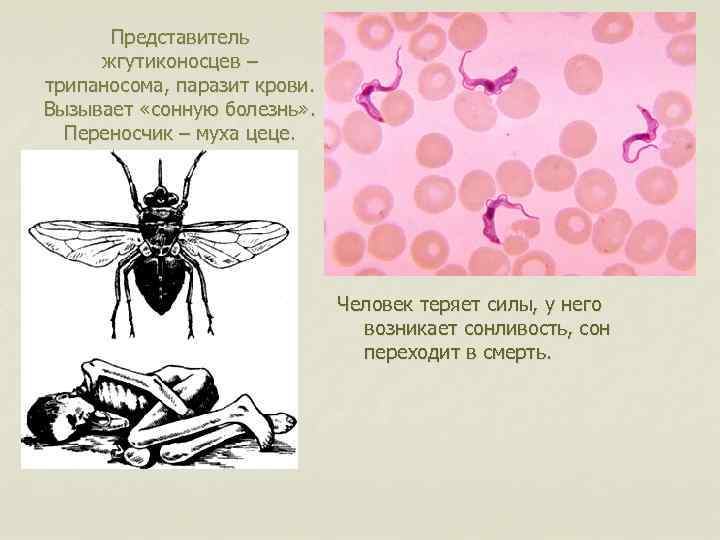
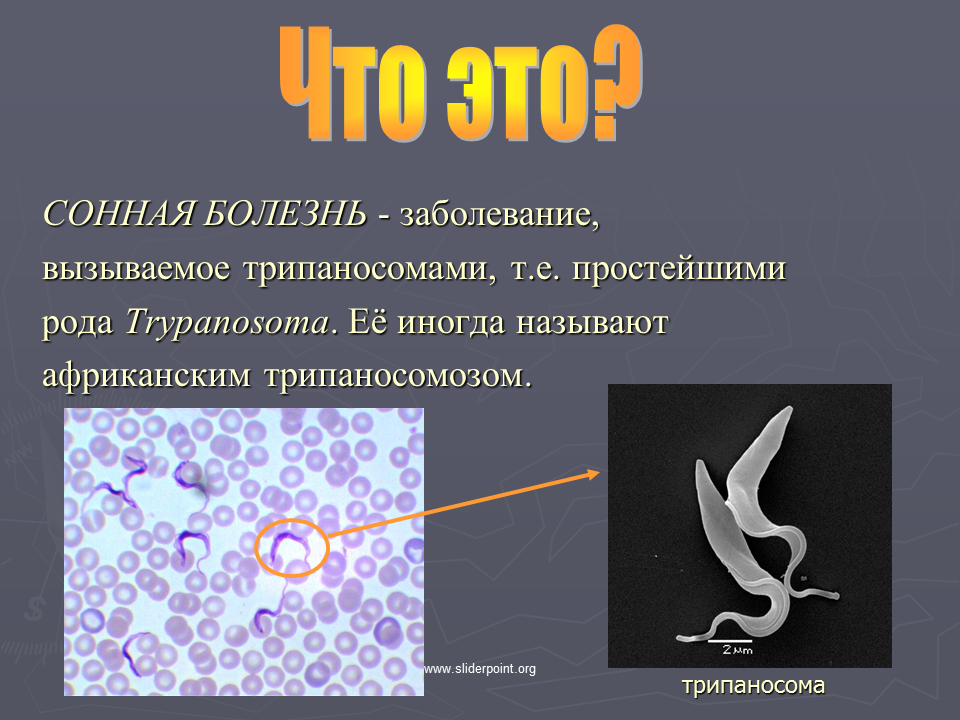
Клиническая картина
Гамбийская форма трипаносомоза отличается длительным хрон. течением. Выделяют два периода болезни: ранний (гематолимфатический) и поздний (менингоэнцефалитическрш). Гемато-лимфатический период продолжается от нескольких месяцев до 5 лет, в среднем — год. На коже в месте укуса мухи цеце через 5 дней возникает первичный аффект — трипаносомный шанкр, или трипанома,— плотный болезненный волдырь диам. 1—2 см, окруженный беловатой восковидной зоной, иногда изъязвляющийся. Обычно он спонтанно исчезает через несколько дней.
При пункции в содержимом волдыря обнаруживают многочисленных паразитов. При выходе трипаносом в лимф, систему и кровь процесс генерализуется; характерным симптомом этого периода болезни является лихорадка неправильного типа, Лихорадочные периоды, длящиеся неделями, сменяются ремиссиями от нескольких дней до нескольких месяцев. На коже могут появиться эритематозные высыпания (трипани-ды), имеющие форму полных или неполных колец. Их преимущественная локализация — грудь, спина, реже лицо и другие части тела. Характерны постоянные головные боли, бессонница, тахикардия. Ранним и частым проявлением этого периода болезни является лимфаденопатия. Увеличиваются брыжеечные и периферические лимф, узлы, особенно характерно увеличение затылочных лимф, узлов (симптом Уинтер-боттома). Они подвижны, обычно безболезненны, в первые 6 мес. мягкие, позже фиброзируются. Обычно увеличивается селезенка, нередко и печень. Появляются периферические отеки, в т. ч. на лице. При отсутствии лечения больные нередко погибают в течение первого периода болезни, но в значительном числе случаев болезнь переходит в менинго-энцефалитический период или собственно сонную болезнь. В этот период появляется сонливость (причем она наблюдается днем, а ночью характерно беспокойство). У больных развиваются тремор рук, ног, языка, фибриллярные подергивания мускулатуры, гиперестезии. Больные болезненно реагируют на привычные шумы, напр, на захлопывание дверей (симптом Керанделя); наблюдаются расстройства зрения, скандированная речь, судороги конечностей, сменяющиеся параличами, нарушение психики вплоть до маразма (см.), выражение лица безучастное. Длительность этого периода 4—8 мес. Прогрессируют общее истощение, изменения в ц. н. с.; обычно больные погибают в коматозном состоянии. У части больных заболевание протекает в стертой форме или ограничивается паразитоносительством.
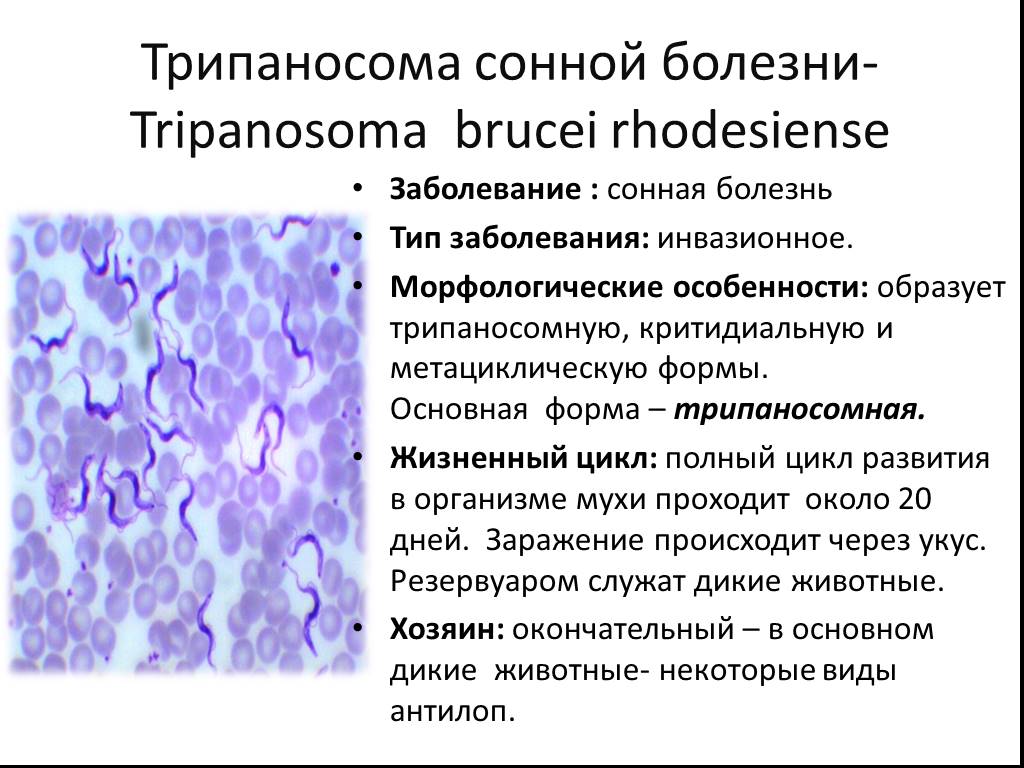
Клиническая картина родезийской формы трипаносомоза характеризуется более острым и коротким течением. Периоды лихорадки более длительны, периоды снижения температуры короче, лимф, узлы часто не увеличиваются, быстрее нарастает слабость, истощение в связи с выраженной интоксикацией. Обычно больные внезапно погибают еще до развития выраженных явлений менингоэнцефалита.
Для обеих форм С. б. характерно частое присоединение интеркуррентных заболеваний, протекающих тяжело вследствие ослабления защитных функций организма. С. б. у детей протекает более остро и характеризуется ранним вовлечением в патол. процесс ц. н. с.
Симптомы африканского трипаносомоза
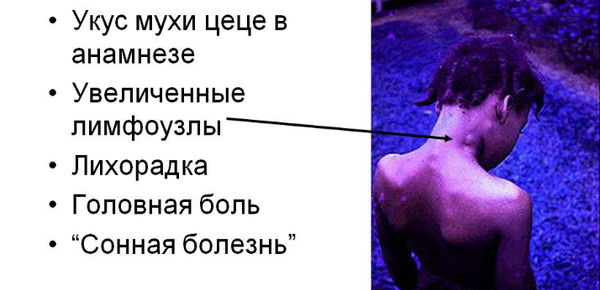
Скрытый период составляет 2-3 недели. По истечении данного отрезка времени больной может обнаружить следующие симптомы африканского трипаносомоза:
- появления шанкра на месте укуса;
- воспаление лимфатических узлов (особенно в затылочной зоне);
- локальные отеки;
- эритематозные пятна;
- боли необъяснимого характера;
- увеличение печени и селезенки;
- судороги;
- гиперемия в вечернее время;
- нарушения сознания;
- истощение.
По мере развития заболевания прогрессирует процесс демиелинизации – повреждение миелиновой оболочки волокон центральной и периферической нервной системы. В связи с этим нарушается и работа головного мозга. Это может привести к коме или летальному исходу. Через несколько месяцев после инфицирования наблюдаются следующие признаки африканского трипаносомоза:
- нарушение контроля сфинктеров;
- сонливость;
- транзисторные параличи;
- дрожание конечностей;
- нарушение речи;
- сердечная недостаточность.
Хроническая форма может протекать бессимптомно.
Профилактика
Наиболее эффективной химической профилактикой заболевания является использование пентамидина, инъекции которого необходимо проводить 1 раз в 6 месяцев. В эндемичных районах рекомендуется ношение закрытой одежды, которая позволит защитить руки и ноги от укусов. Также необходимо избегать визитов в приусадебные строения, ветхие дома. Желательно использование инсектицидных средств в виде спреев, а также москитных сеток.
Не реже, чем 2 раз в год (накануне сезона заражения) проводится серологическое исследование населения. В первую очередь обследуют людей, проживающих в зонах обитания мух цеце. Выявленные носители инфекции подлежат лечению в изолированных условиях.
Борьба с переносчиками заболевания – второе профилактическое направление. В горячих точках широко используются насыщенные ядохимикатами экраны и ловушки, задача которых заключается в активном привлечении и уничтожении мух цеце. Место расположения таких устройств – внутри поселков, на пути перемещения жителей, а также на рабочих местах.
В сезон эпидемий прибегают к масштабному распылению инсектидных средств, в том числе методом авиаобработки, что позволяет резко сократить количество насекомых. Места их возможного обитания дополнительно обрабатывают ядохимикатами, используя для этого мобильные установки.
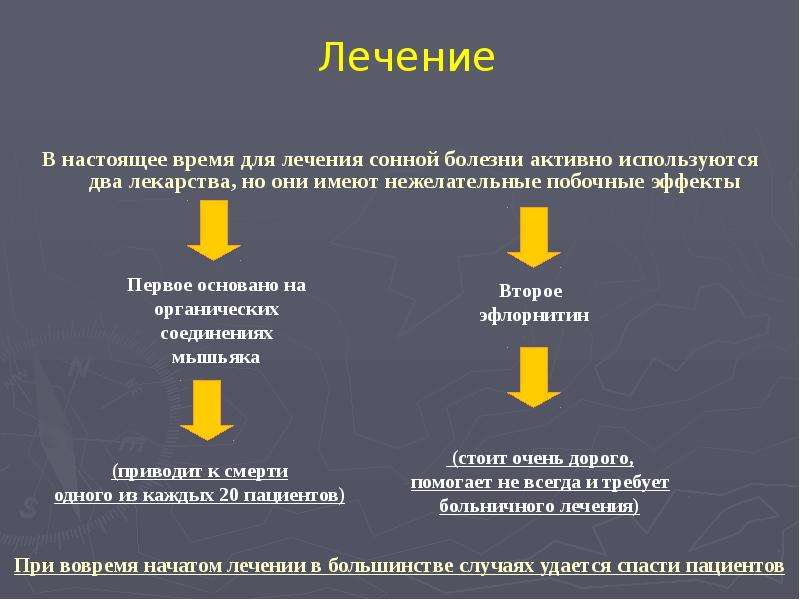
Лечение
Тип лечения зависит от формы и стадии заболевания. Раннее выявление болезни повышает шансы на успешное излечение. Ввиду того что паразит может сохранять жизнеспособность в течение длительного времени и вызывать рецидивы через много месяцев после окончания терапии, для оценки результатов лечения пациенты должны оставаться под наблюдением в течение периода продолжительностью до 24 месяцев, в рамках которого следует проводить клиническое обследование пациентов и выполнять лабораторные исследования физиологических жидкостей, в том числе в некоторых случаях спинномозговой жидкости, полученной путем люмбальной пункции.
Для успешного лечения болезни на второй стадии необходимо применение лекарственных препаратов, способных преодолевать гематоэнцефалический барьер и нейтрализовать паразита в центральной нервной системе.
Препараты для лечения болезни на первой стадии:
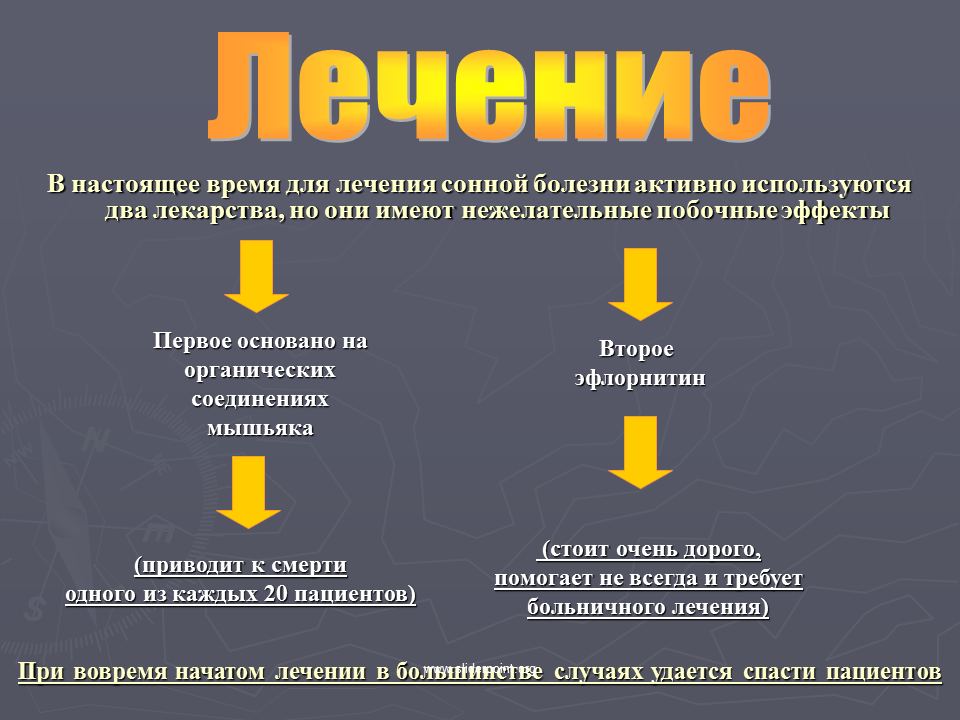
- Пентамидин: впервые получен в 1940 г., используется для лечения сонной болезни, вызванной T.b. gambiense, на первой стадии. Несмотря на наличие серьезных побочных эффектов, препарат в целом хорошо переносится.
- Сурамин: впервые получен в 1920 г., используется для лечения болезни, вызванной T.b. rhodesiense, на первой стадии. Препарат имеет ряд нежелательных побочных эффектов, включая нефротоксическое действие и аллергические реакции.
Препараты для лечения болезни на второй стадии:
Препараты для лечения заболевания на обеих стадиях:
Фексинидазол – пероральный препарат для лечения гамбийской формы африканского трипаносомоза человека. В 2019 г. препарат был включен в Перечень основных лекарственных средств ВОЗ и рекомендован в руководстве ВОЗ по лечению африканского трипаносомоза человека. Препарат показан в качестве терапии первой линии на первой и нетяжелой второй стадии заболевания. Он принимается в течение 10 дней через 30 минут после приема твердой пищи под наблюдением квалифицированного медицинского персонала. В настоящее время проводятся клинические испытания этого препарата для лечения родезийской формы трипаносомоза.
Лечение
Лечение наиболее эффективно в раннем периоде болезни. Анализ клин, данных и результатов исследования цереброспинальной жидкости позволяет определить, вовлечена ли в патол. процесс ц. н. с. и в зависимости от этого выбрать тактику химиотерапии. В раннем периоде болезни, если ц. н. с. не поражена, применяют сурамин или пентами-дин. Сурамин показан для лечения обеих форм С. б. Его вводят внутривенно, готовя 10% р-р ex tempore в дозе до 20 мг!кг, но не более 1,0 г. Рекомендуется прерывистая схема введения: вначале — каждый второй, а в дальнейшем — каждый пятый или каждый седьмой день, всего 5 инъекций на курс. При болезнях почек сурамин не назначают. Лечение им проводят под контролем функции почек: появление умеренной лейкоциту рии (см.), протеину рии (см.) закономерно. Высокая протеинурия, цилиндрурия, появление эритроцитов в моче свидетельствуют о развитии токсического нефрита (см.) и служат показанием для прерывания курса химиотерапии.
Пентамидин эффективен только при гамбийской форме С. б. Его применяют внутримышечно в суточной дозе 3—4 мг!кг в течение 7—10 дней подряд или через день, на курс 8— 10 инъекций. Сурамин и пентамидин можно применять сочетанно.
В позднем периоде болезни применяют меларсопрол (арсобал) или другие мышьяковистые препараты, хорошо проникающие через гемато-энцефалический барьер в ткань мозга
Препарат отличается высокой эффективностью, но применять его следует с большой осторожностью, т. к
он может вызывать реактивную энцефалопатию с летальным исходом. Назначают в дозе 1,8— 3,6 мг/кг внутривенно в течение 3 сут. После недельного перерыва проводят второй такой же курс и при необходимости — третий. Препарат вводят строго в вену сухой иглой, т. к. при попадании даже капли его в кожу возникает сильное раздражение и длительный отек. Необходимо назначение дезинтоксикаци-онных, гипосенсибилизирующих, симптоматических средств.
Как проявляется сонная болезнь?
У некоторых пациентов на месте заражения паразитами появляется болезненный трипаносомальный шанкр.
В 1 стадии болезни возникает повышение температуры тела. Обычно приступы высокой температуры длятся несколько дней и разделены периодами афебрилитета.
Повышение температуры тела
Трипаносомоз T. gambiense выражается лимфаденопатией. Лимфатические узлы увеличиваются, подвижны, эластичны и безболезненны.
- Часто наблюдается зуд и сыпь.
- Иногда наблюдается слабость, головная боль, артралгия, похудание, отеки, гепатоспленомегалия.
Инвазия в ЦНС (2 стадия заболевания) характеризуется постепенным развитием различных неврологических проявлений, которые сопровождаются прогрессирующими нарушениями спинномозговой жидкости.
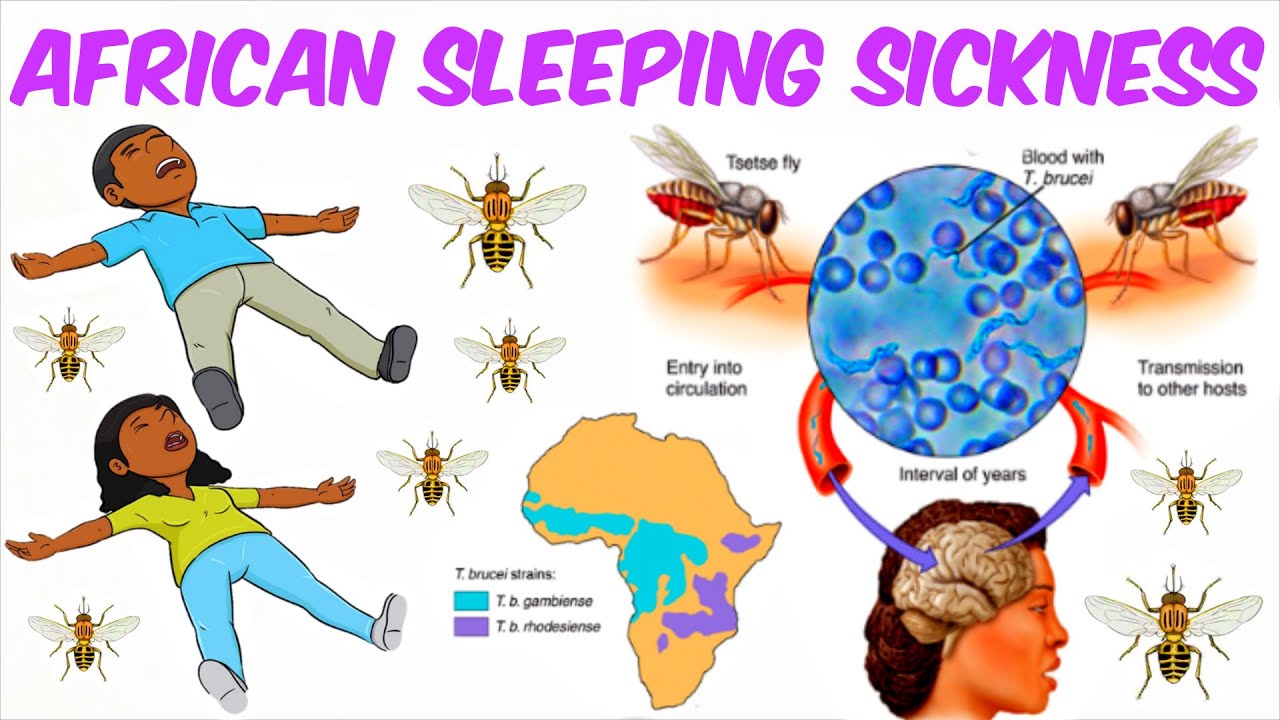
- В течение дня развиваются прогрессирующее безразличие и сонливость (поэтому болезнь и получила название «болезнь сна»), которые иногда сменяются возбуждением и бессонницей ночью.
- У пациентов безразличный вид, низкая подвижность, речь становится прерывистой и невнятной.
- В терминальной фазе прогрессирующие неврологические расстройства заканчиваются комой и смертью.
Наиболее существенное различие между трипаносомозом Западной и Восточной Африки состоит в том, что на Востоке болезнь протекает более остро. У туристов системные признаки инфекции, такие как лихорадка, недомогание и головная боль, появляются до окончания поездки или сразу после возвращения домой.
Часто на ранней стадии заболевания, вызванного Tb rhodesiense, возникает тахикардия, не связанная с лихорадкой. Смерть может наступить из-за аритмий и застойной сердечной недостаточности до развития заболевания ЦНС. Без лечения трипаносомоз из Восточной Африки обычно приводит к смерти в течение нескольких недель или месяцев, часто без четкого различия между стадией 1 и 2.
Тахикардия
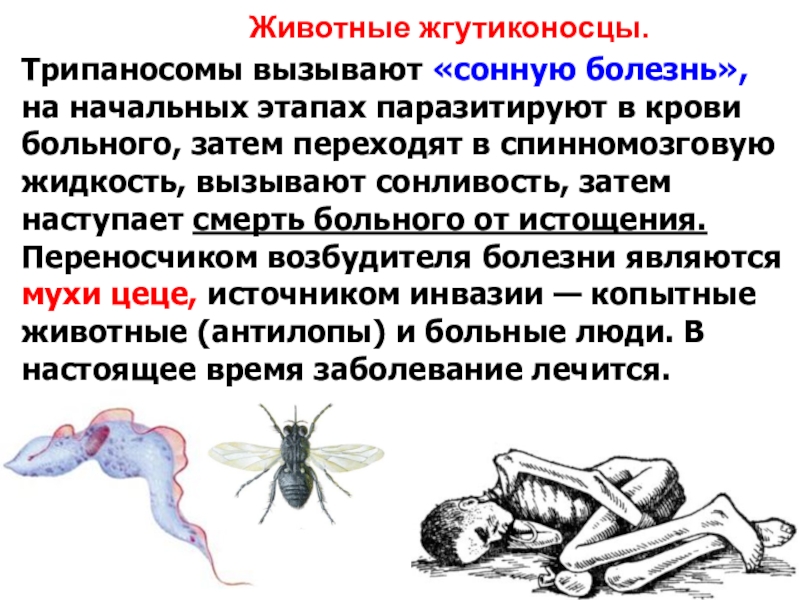
Сонная болезнь
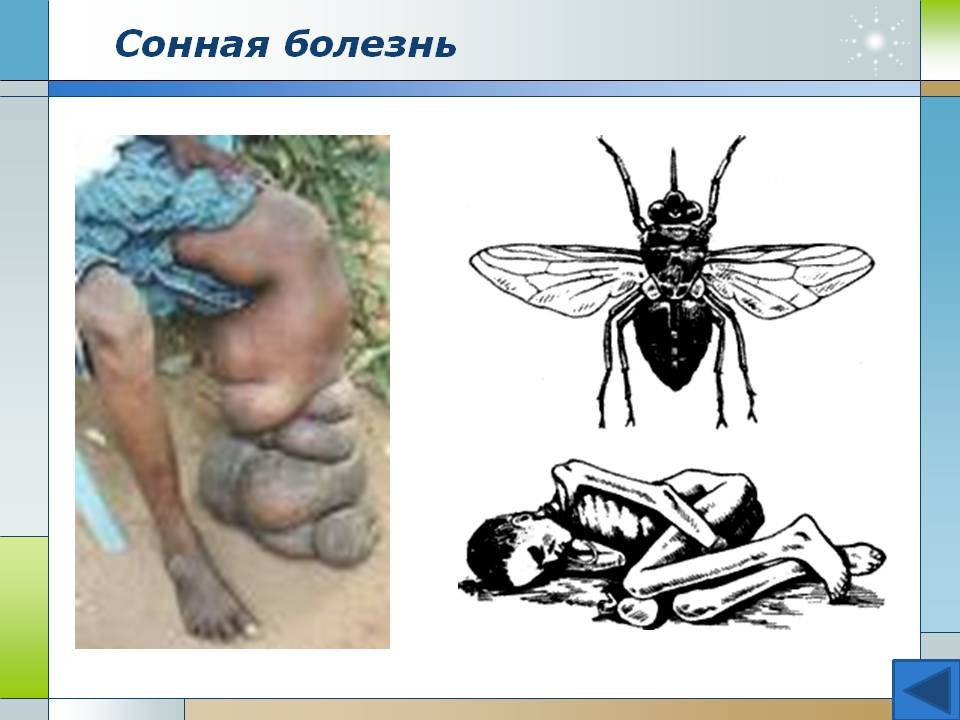
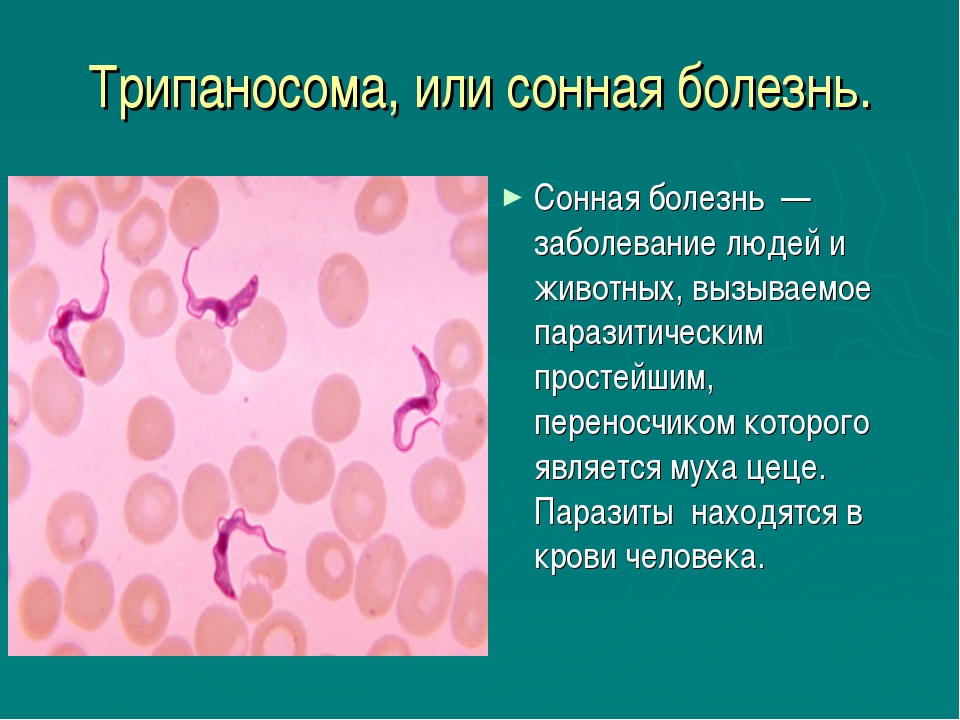
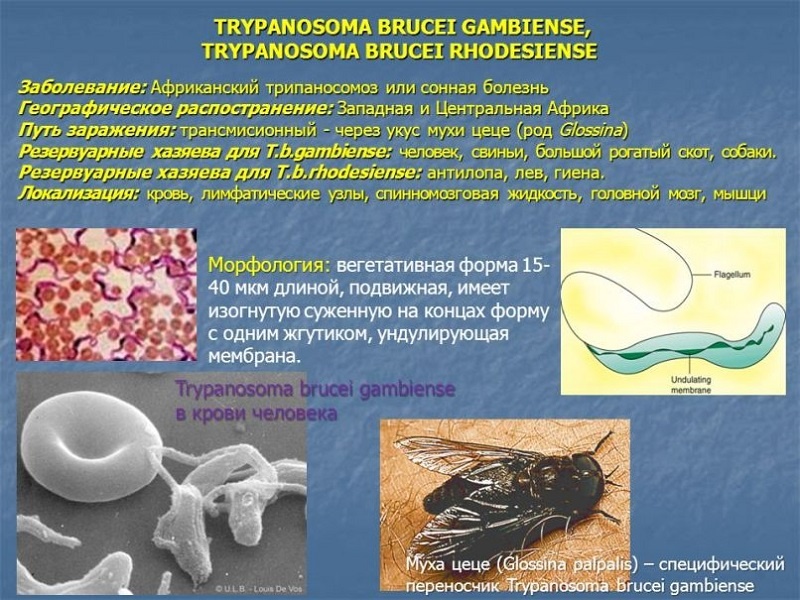
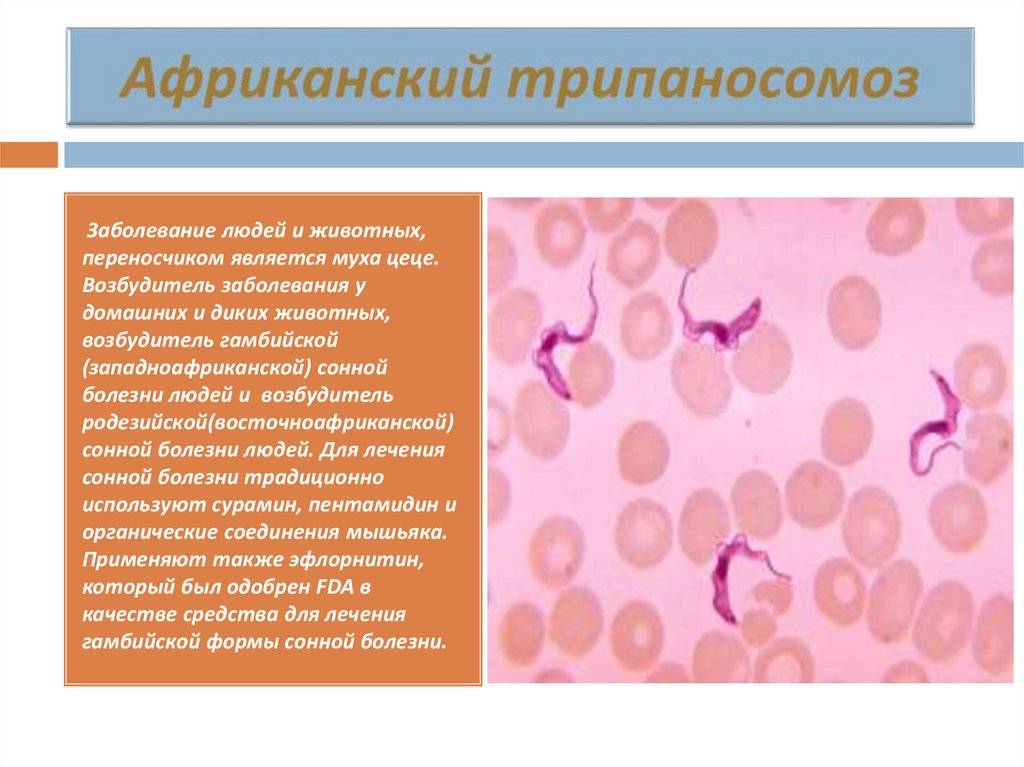
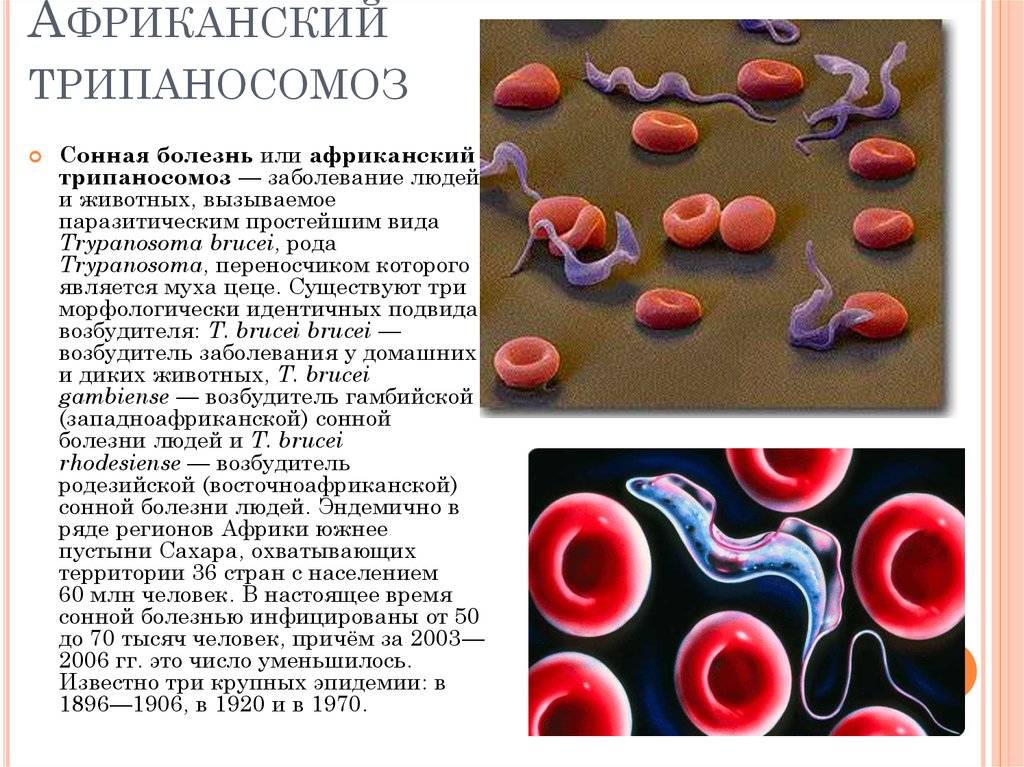
Сонная болезнь или африканский трипаносомоз − заболевание людей и животных, вызываемое паразитическим простейшим вида Trypanosoma brucei, переносчиком которого является муха цеце.
В 1896-1906 годах Уганду и бассейн реки Конго поразила эпидемия сонной болезни. Болезнетворный агент и переносчик инфекции открыл в 1902-1903 годах Дэвид Брюс. Первое эффективное лекарство атоксил (на основе мышьяка) было разработано Паулем Эрлихом и Киёси Сигой и введено в практику в 1910 году. Препарат, однако, оказался токсичным для человека и мог вызвать слепоту в 82% случаев.
Этиология
Заражение человека происходит при укусе насекомого-переносчика − мухи цеце. Обычно заражение человека возбудителем западноафриканского трипаносомоза происходит недалеко от водоемов и вдоль берегов рек, в то время как заражение возбудителем восточноафриканского трипаносомoза − в саваннах и на местах недавно вырубленных тропических лесов.
Сонная болезнь эндемична в 36 странах тропической Африки. Ежегодно регистрируется до 40 тысяч новых случаев. Вероятно, реальное число заболевших значительно больше и может составлять до 300 тысяч. Около 50 миллионов человек проживают в условиях риска заражения.
Основным хозяином является человек, дополнительным − свиньи.
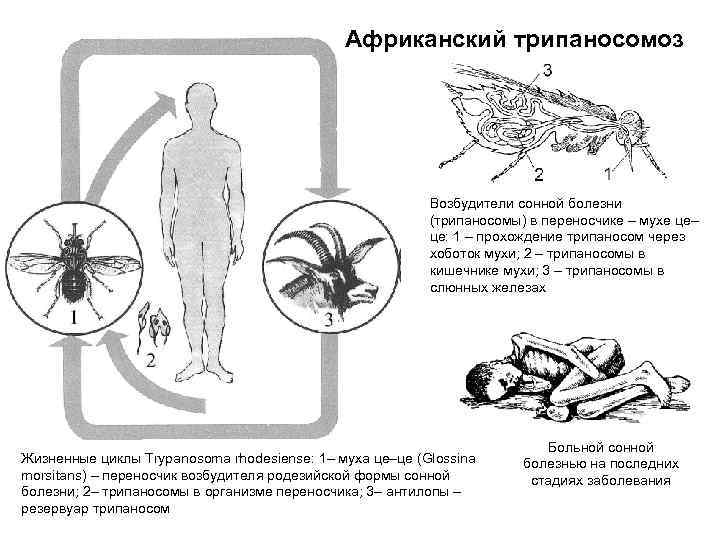
Мухи цеце нападают в светлое время суток, преимущественно на открытой природе, некоторые антропофильные виды могут залетать в поселки. Кровь пьют и самцы, и самки. В организм переносчика трипаносомы попадают при питании кровью инвазированного позвоночного животного или человека. Около 90% трипаносом, поглощенных мухой цеце, погибают.
Достаточно одного укуса зараженной мухи, чтобы человек заболел сонной болезнью, муха со слюной за один укус выделяет около 400 тысяч трипаносом. Больной становится источником инвазии примерно с десятого дня после заражения и остается им на протяжении всего периода болезни, даже в период ремиссии и отсутствия клинических проявлений.
Заболеваемость носит сезонный характер. Пик приходится на сухой сезон года, когда мухи цеце концентрируются около оставшихся не пересохшими водоемов, интенсивно используемых населением для хозяйственных нужд.
Симптомы
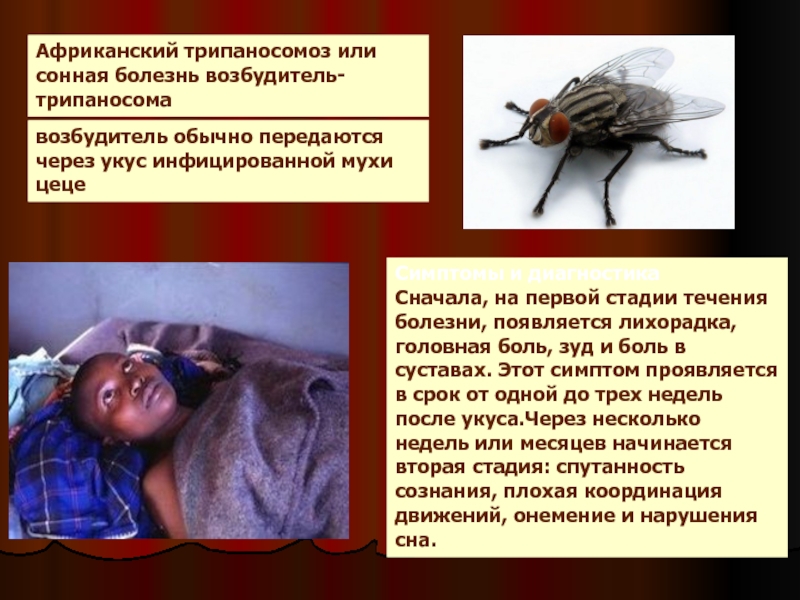
После укуса мухи цеце начинается инкубационный период, который длится 1-3 недели. На месте укуса иногда формируется трипаносомидный шанкар, в котором паразиты активно размножаются, проникая в ткани, кровь и лимфу, и который исчезает через 5-7 дней. Первыми симптомами являются приступы лихорадки, головные боли и боли в суставах, часто сильно увеличиваются в размерах лимфатические узлы. У некоторых больных формируются большие вздутия шейных и затылочных узлов. Если не начать лечение, болезнь продолжает прогрессировать, вызывая анемию, нарушения в работе сердца, почек, эндокринной системы.
Профилактика
Комплекс мероприятий по оздоровлению очагов сонной болезни включает выявление и лечение африканского трипаносомоза, общественную и индивидуальную профилактику населения, борьбу с переносчиками. Имеет значение серологическое обследование, прежде всего людей, относящихся к группе риска (охотники, лесорубы, строители дорог и др.). Обследование должно проводиться не реже двух раз в год (перед сезоном и после сезона наибольшей опасности заражения).
Источник
Диагностика болезни
При подозрении на наличие у пациента африканского трипаносомоза необходимо срочно обращаться к врачу. Прежде всего, специалист делает опрос о возможности пребывания человека или его родственников в районах африканского континента за последние месяцы, затем проводит общий осмотр состояния пациента и направляет на анализы.
Лабораторная диагностика для определения трипаносомы африканской включает:
- анализы крови и лимфы;
- пункцию спинномозговой жидкости для анализа (присутствие паразита в этом анализе является сигналом к тому, что пройден гематоэнцефалитический барьер);
- внешний осмотр места укуса, берется для исследований содержимое шанкра.
Прогноз течения болезни:
- благоприятный, если лечение начато до поражения нервной системы;
- при проявлении симптомов поражения ЦНС положение более тяжелое, и прогноз зависит от состояния организма больного;
- отсутствие лечения — коматозное состояние и 100%-й летальный исход.
Эпидемиология
Основным источником Т. gambiense является человек (больной или паразитоноситель), однако паразита находили также у свиней, коров, овец. Переносчиками Т. gambiense являются мухи цеце группы paipalis (Glossina paipalis, G. tachinoides, G. fuscipes и др.), к-рые питаются на людях, а также на домашних животных. На основании этого допускается, что дополнительным источником инвазии может быть домашний скот. Мухи группы palpalis обитают на территориях Центральной и Западной Африки, отличающихся повышенной влажностью, гл. обр. в лесах и в густых зарослях по долинам рек. Мухи нападают днем, зараженность их трипаносомами обычно невелика (ок. 1%). Контакт мух с людьми и домашним скотом резко возрастает в засушливые сезоны, когда число и площадь водоемов уменьшается, люди и животные концентрируются около оставшихся водоемов. В такие периоды интенсивность передачи возбудителей в очагах возрастает, возможны эпидемические вспышки. Болеют преимущественно сельские жители. Часть инвазированных лиц остается паразитоносителями (см. Носительство возбудителей инфекции). Эндемичные по гамбийскому трипаносомозу территории имеют тенденцию уменьшаться под влиянием деятельности человека, однако все местности, заселенные мухами цеце, должны рассматриваться как потенциально эпидемически опасные.
Источник инвазии Т. rhodesien-se — антилопы, возможно, другие дикие животные и человек. Переносчиками возбудителя являются мухи цеце группы morsitans (G. morsi-tans, G. pallidipes, G. swynnertoni и др.). Их биотопами являются кустарниковые заросли восточноафриканских саванн и чащи по берегам озер, основными «прокормителями» — дикие животные (антилопы, дикие кабаны и др.). Родезийский трипаносомоз — природно-очаговая инвазия. Люди подвергаются нападению мух цеце и заражаются Т. rho-desiense при посещении природного очага с целью охоты, рыбной ловли. В селениях очаги С.б. возникают при большой численности мух G. morsitans. Передача возбудителей в этих случаях происходит по цепи больной человек — муха — человек.
Крупные эпидемии
За последнее столетие в Африке произошло несколько эпидемий:
- эпидемия 1896-1906 гг., преимущественно затронувшая Уганду и бассейн реки Конго;
- эпидемия 1920 г., затронувшая ряд африканских стран; и
- последняя по времени эпидемия, начавшаяся в 1970 г. и продолжавшаяся до конца 1990-х гг.
В 1920 г. борьба с эпидемией велась силами передвижных бригад, которые выполняли скрининг миллионов людей, проживающих в районах высокого риска. К середине 1960-х гг. распространение болезни было взято под контроль, и на всем континенте регистрировалось менее 5 000 случаев заболевания. После такого успеха эпиднадзор был ослаблен, в связи с чем болезнь вернулась, и к 1970 г. в нескольких регионах ее вспышки разрослись до эпидемии. В 1990-е гг. и в начале XXI века благодаря усилиям ВОЗ, осуществлению национальных программ по борьбе с болезнью, двустороннему сотрудничеству и деятельности неправительственных организаций (НПО) тенденция к росту заболеваемости была остановлена.
Поскольку число новых случаев заболевания африканским трипаносомозом человека за период с 2000 по 2012 г. значительно сократилось в результате международных координированных усилий, в Дорожной карте ВОЗ по борьбе с забытыми тропическими болезнями была поставлена цель по его элиминации как проблемы общественного здравоохранения к 2020 г. и ликвидации передачи инфекции (сведение числа случаев к нулю) к 2030 г.
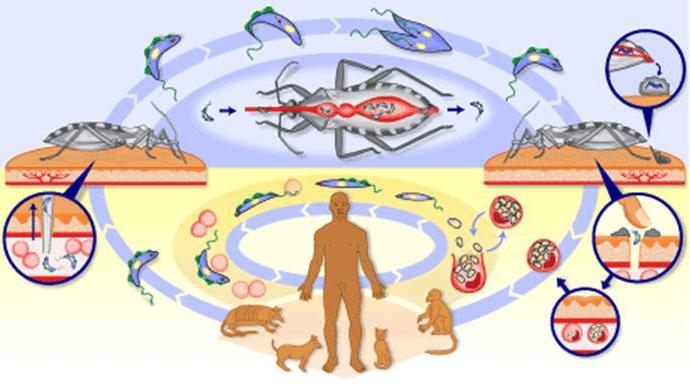
Жизненный цикл трипаносомы
При активной деятельности паразита происходит впитывание питательных веществ из клеток организма хозяина и выбрасывание в него токсических отходов.
Жизненный цикл трипаносомы состоит из 2-х основных стадий: инфекционной и диагностической. Началом его считается попадание паразита в организм насекомого-переносчика.
На 1-й стадии в организм мухи трипаносома проникает после укуса ею больного животного, затем она размножается бинарным делением. Через некоторое время трипомастиготы из средней кишки проходят в слюнные железы, где происходит процесс превращения в эпимастиготы. Кровососущие мухи имеют специальный хитинизированный хоботок, который легко прокалывает кожу не только человека, но и слона или буйвола.
Процесс развития паразита в теле насекомого продолжается 15-35 дней и зависит от температуры окружающей среды. Зараженная трипаносомами муха способна передавать их всю жизнь.
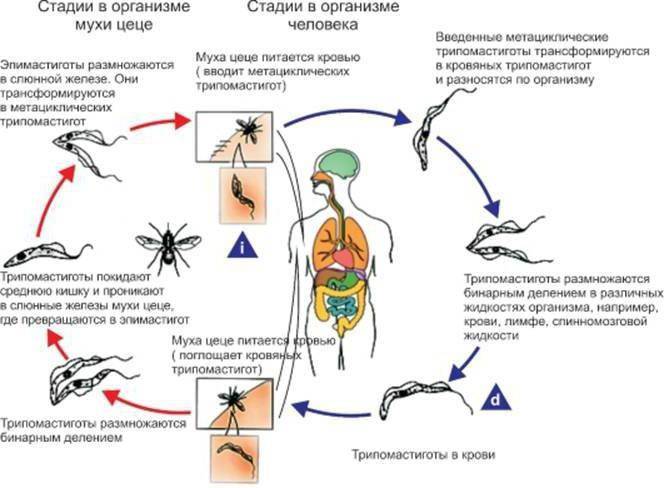
После проникновения возбудителя в организм человека начинается 2-я стадия, диагностическая, которая может быть уже диагностирована специалистами.
Осложнения ДКБ
Чаще всего пациенты страдают от хронического синдрома Меньера, при котором патология затрагивает среднее ухо. Человек испытывает головокружение, постепенно ухудшается слух. Еще одно возможное нарушение — аэропатический миелоз, который представляет собой поражение клеток костного мозга.
При средних и тяжелых вариантах заболевания возникают всевозможные сердечные патологии воспалительного и дегенеративного характера. Среди наиболее распространенных — эндокардит и миокардит, кардиосклероз. Со стороны дыхательной системы может развиться пневмония. Из неврологических проявлений болезни чаще всего отмечают парезы, паралич мышц, потерю чувствительности.
Основные факты
- Возбудителями сонной болезни, или африканского трипаносомоза человека, являются паразиты рода трипаносом, передающиеся инфицированными мухами цеце; данная болезнь является эндемичной в 36 странах Африки к югу от Сахары, где водятся мухи цеце – ее переносчики. При отсутствии лечения болезнь считается смертельной.
- К группам высокого риска укуса мух цеце относятся жители сельских районов, занимающиеся сельским хозяйством, рыболовством, животноводством или охотой.
- Африканский трипаносомоз вызывают паразиты двух подвидов, причем более чем в 95% всех зарегистрированных случаев возбудителем является Trypanosoma brucei gambiense.
- Систематические усилия по борьбе с заболеванием позволили сократить число новых случаев. В 2009 г. впервые за 50 лет число установленных новых случаев болезни упало ниже отметки 10 000 случаев, а в 2019 и 2020 гг. было зарегистрировано соответственно 992 и 663 случая.
- Диагностика и лечение этой болезни сложны и требуют наличия специально обученного персонала.
Африканский трипаносомоз человека, также известный как сонная болезнь, относится к трансмиссивным паразитарным заболеваниям. Его возбудителям являются паразитирующие простейшие, принадлежащие к роду трипаносом. Они передаются человеку при укусе мухи цеце (род Glossina), инфицированной от людей или животных, выступающих в роли хозяев этих патогенных для человека паразитов.
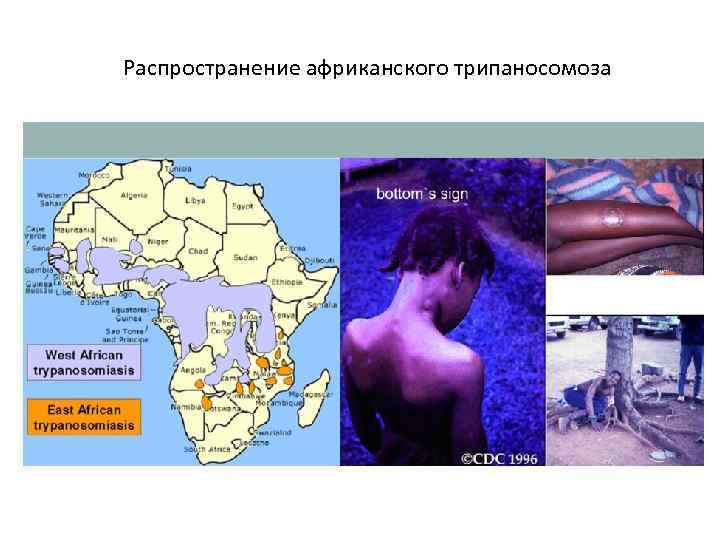
Муха цеце обитает только в Африке к югу от Сахары, и передавать болезнь могут лишь некоторые ее виды. По неизвестным на сегодняшний день причинам во многих районах ареала обитания мухи цеце случаи сонной болезни не отмечаются. Наиболее подвержены укусам мухи цеце и, следовательно, данной болезни жители эндемичных сельских районов, занимающиеся сельским хозяйством, рыболовством, животноводством и охотой. Случаи болезни могут отмечаться как на территории отдельных деревень, так и в целом регионе. В пределах отдельно взятого инфицированного района интенсивность распространения болезни может сильно варьироваться от одного сельского поселения к другому.
Текущий ареал распространения заболевания
Показатели распространенности болезни варьируются между странами, а также между районами на территории отдельно взятой страны.
- За последние пять лет более 70% случаев болезни было зарегистрировано в Демократической Республике Конго, где ежегодно официально регистрируется в среднем менее 1000 заболевших.
- В 2019 г. в Анголе, Центральноафриканской Республике, Чаде, Конго, Габоне, Гвинее, Малави и Южном Судане было зарегистрировано от 10 до 100 новых случаев заболевания, а в Камеруне, Кот-д’Ивуаре, Экваториальной Гвинее, Уганде, Объединенной Республике Танзания, Замбии и Зимбабве – от 1 до 10 новых случаев.
- В течение последних 10 лет о единичных случаях заболевания сообщалось в таких странах, как Буркина-Фасо, Гана и Нигерия.
- В Бенине, Ботсване, Бурунди, Эфиопии, Гамбии, Гвинее-Биссау, Либерии, Мали, Мозамбике, Намибии, Нигере, Руанде, Сенегале, Сьерра-Леоне, Эсватини и Тога за последние 10 лет новых случаев заболевания не регистрировалось. В некоторых из этих стран передача инфекции, по всей видимости, прекратилась, однако точно оценить реальное положение дел в некоторых районах сложно, поскольку проведению эпиднадзора и диагностики препятствуют социальная нестабильность и/или трудности в доступе к населению.
Лечение
При незначительных проявлениях болезни пациент находится дома или в больнице под наблюдением врача. При средней и тяжелой степенях необходимо провести рекомпрессию, которая проходит в барокамере и позволяет нормализовать состояние пациента.
Рекомпрессия состоит из нескольких этапов. Сначала давление повышается, как будто человек снова находится на глубине. В таких условиях человек находится от получаса и более. После нормализации состояния давление постепенно снижают, имитируя подъем на поверхность воды. Также производится подача кислорода, который вытеснит азот из крови. В некоторых случаях процедуру приходится повторять.
Если у пациента развились осложнения, то назначают симптоматическое лечение, физиотерапию. По статистике, 80% людей с “болезнью дайвера” возвращаются к прежней жизни без последствий для здоровья при своевременном лечении.
Частно-государственные партнерства
В 2000 и 2001 гг. ВОЗ учредила частно-государственное партнерство с компаниями Aventis Pharma (в настоящее время Sanofi) и Bayer HealthCare, в результате чего была создана программа по эпиднадзору и борьбе с данным заболеванием под руководством ВОЗ, в рамках которой эндемичным странам предоставляется поддержка в осуществлении противоэпидемических мероприятий и бесплатно поставляются лекарственные препараты.
Партнерство неоднократно продлевалось в 2006, 2011, 2016 и 2021 г. Успехи в сокращении числа случаев сонной болезни и появление реальной перспективы ее элиминации побудили ряд других партнеров из частного сектора поддержать инициативу ВОЗ по элиминации болезни как проблемы общественного здравоохранения и обеспечению ликвидации передачи инфекции к 2030 г.
Деятельность ВОЗ
ВОЗ оказывает содействие и техническую поддержку национальным программам по борьбе с сонной болезнью.
Организация на безвозмездной основе поставляет эндемичным странам противотрипаносомные лекарственные средства в рамках частно-государственных партнерств с компаниями Sanofi (пентамидин, меларсопрол, эфлорнитин и фексинидазол) и Bayer HealthCare (сурамин и нифуртимокс). Отгрузка и транспортировка лекарственных препаратов осуществляется совместно с логистическим отделением организации «Врачи без границ» MSF-Logistics.
Для содействия разработке новых и недорогостоящих средств диагностики ВОЗ в 2009 г. создала банк образцов биоматериалов, которыми могут пользоваться исследователи. В банке, размещенном в Институте Пастера в Париже, хранятся образцы крови, сыворотки, спинномозговой жидкости, слюны и мочи, взятые у пациентов, инфицированных обеими формами болезни, а также образцы, взятые у неинфицированных людей из эндемичных районов.
В 2014 г. в целях активизации и поддержки усилий по элиминации болезни по инициативе ВОЗ была создана координационная сеть по африканскому трипаносомозу человека. В число партнеров этой сети вошли национальные программы по борьбе с сонной болезнью, организации, занимающиеся созданием новых лекарственных и диагностических средств, международные и неправительственные организации, а также организации-доноры.
Виды трипаносом и формы заболевания
Африканский трипаносомоз — смертельно опасное заболевание, при котором поражается нервная система человека. Для ранних его стадий симптомы очень смазанные, поэтому часто пациенты не догадываются о том, что заражены. Болезнь характеризуется длительным циклом развития (недели, месяцы и даже годы), в течение которого инфицированный человек становится удобным резервуаром для жизни и размножения паразита.
Возбудителями африканского трипаносомоза являются 3 вида микроорганизмов:
- Tripanosoma brucei brucei — заражает домашних и диких животных, случаи заболевания человека не зарегистрированы, но вероятны.
- Tripanosoma brucei gambiense — возбудитель гамбийской, или западноафриканской, формы болезни у человека.
- Tripanosoma brucei rhodesiense — вызывает у людей родезийский, или восточноафриканский, тип заболевания.
Два основных вида болезни (гамбийский и родезийский) отличаются между собой по региону распространения и клинической картине, причем первая форма составляет 98% случаев заражения сонной болезнью. Для нее характерно более длительное течение и постепенное ухудшение состояния пациента.
Родезийскую форму трипаносомоза отличает быстрое прогрессирование болезни и всех ее признаков, уже в течение первого года возможно появление симптомов поражения ЦНС.
Трипаносомоз животных
Другие виды и подвиды паразитов рода Trypanosoma являются патогенными для животных и вызывают трипаносомоз у некоторых видов диких и домашних животных. Трипаносомоз крупного рогатого скота называют нагана. Трипаносомоз домашних животных, особенно крупного рогатого скота, серьезно подрывает экономическое развитие инфицированных сельских районов.
Животные могут быть носителями патогенных для человека паразитов, особенно T.b. rhodesiense, причем домашние и дикие животные являются важным резервуаром последнего. Животные могут быть также инфицированы T.b. gambiense и, вероятно, могут также выступать в качестве его резервуара, хотя и в меньшей степени. Тем не менее реальная роль животного резервуара в эпидемиологии гамбийской формы болезни до сих пор недостаточно изучена.
Географическое распространение
C. б. определяется ареалом мух цеце. Эти теплолюбивые и влаголюбивые насекомые африканского континента обитают в зоне с годовой суммой осадков более 500 мм. Гамбийская форма встречается во многих странах Западной и Центральной Африки, родезийская — гл. обр. в Уганде, Танзании, Замбии. В западной Африке в 70-е гг. 20 в. ежегодно регистрировалось в среднем ок. 8,5 тыс. случаев гамбийской формы С. б. Число регистрируемых случаев С. б. родезийской формы составляет в среднем 1,5 тыс. в год. Мухи цеце зарегистрированы в 36 странах Африки, и риску заражения, по данным ВОЗ, подвергаются ок. 35 млн. жителей.
Степени тяжести кессонной болезни
В зависимости от симптомов выделяют три степени тяжести заболевания:
легкая. При легкой степени патологии пациент испытывает боли в мышцах и суставах, что связано с давлением на нервные окончания воздушных пузырьков. Из-за закупорки поверхностных сосудов и потовых желез начинается зуд кожи, она становится более жирной;
средняя. Патология средней тяжести вызывает ухудшение координации движений, нарушение зрения, расстройство работы органов ЖКТ. Это связано со скоплением газов в сосудах брыжейки и кишечника;
тяжелая. Основной признак патологии — поражение спинного мозга из-за сдавливания нервной ткани. В некоторых случаях в патологический процесс вовлечен головной мозг. Это проявляется нарушениями в работе сердца и дыхательной системы. Кроме этого, в особо тяжелой стадии пузырьки воздуха перекрывают жизненно важные сосуды, что приводит к остановке кровоснабжения легочной ткани, у человека развивается острая сердечная недостаточность.
Даже при умеренной тяжести патологии острая “болезнь дайвера” может приводить к тяжелым поражениям органов и систем. При отсутствии лечения эти состояния угрожают жизни.